CONFIGURACIÓN ELECTRÓNICA
Se entiende por configuración electrónica la distribución más estable, y por tanto, más probable de los electrones en torno al núcleo.
Para distribuir los electrones en los distintos niveles de energía tenemos en cuenta los siguientes pricipios y reglas:
- Principio de relleno o Aufbau. Los electrones entran en el átomo en los distintos orbitales de energía ocupando primero los de menor energía.
Aspectos espaciales de los orbitales atómicos.-
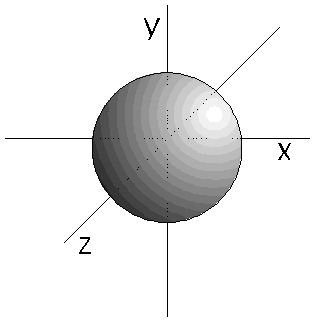
- Los orbitales s (l=0) son esféricos. Su volumen depende del valor de n.
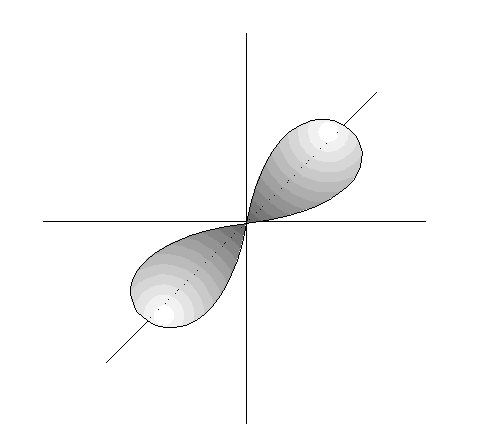
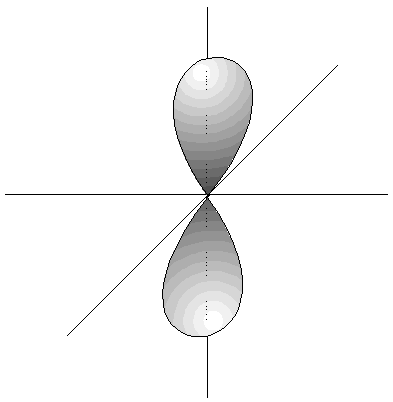
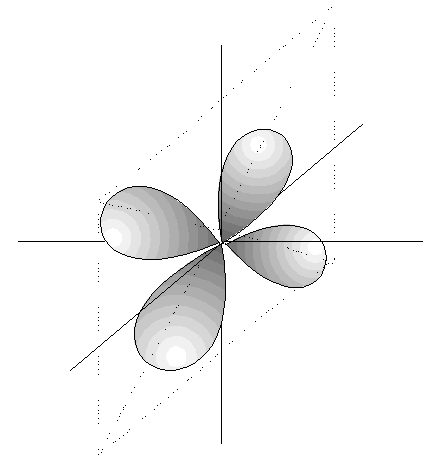
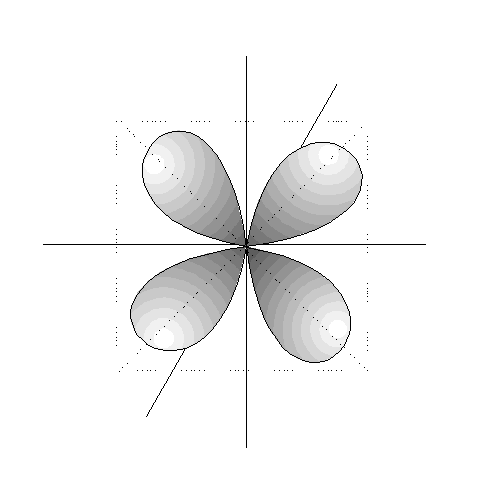
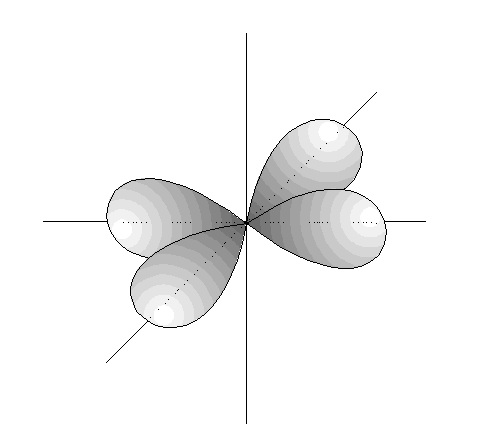
- Los orbitales p son 3, tienen forma de 2 lóbulos unidos por los extremos y orientados en la dirección de los 3 ejes del espacio.

- Los orbitales d son 5, cuya disposición y orientación dependen de los valores de m.




 Para saber el orden de energía de los orbitales se usa el diagrama de Mouller.
Para saber el orden de energía de los orbitales se usa el diagrama de Mouller.
O Bien se sigue esta regla: "Los orbitales menos energéticos son los de menor valor de n+l. Si los orbitales tienen el mismo valor de n+l, tandrá menos energía los de menor valor de n".De acuerdo con estas reglas el orden es el siguiente:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7sSin embargo, este orden teórico presenta algunas excepciones. Por ejemplo, en las configuraciones de los lantánidos, aunque en teoría los orbitales 4f son más energéticos que los 5d, en realidad el átomo coloca primero un electrón en el 5d que entonces se vuelve más energético, y empieza a rellenar los 4f.
- Principio de exclusión de Pauli. No pueden existir dentro de un átomo dos electrones con sus 4 números cuánticos iguales. La consecuencia de esto es que en un orbital sólo puede haber 2 electrones con spines diferentes.
- Principio de Hund o de máxima multiplicidad. Un segundo electrón no entra en un orbital que esté ocupado por otro mientras que haya otro orbital desocupado de la misma energía (o sea, igual los valores de n y l)
PARA SABER MÁS:
ESTRUCTURA ATÓMICA
No hay comentarios:
Publicar un comentario